En varios artículos hemos hablado del papel del CO2 o dióxido de carbono en el calentamiento global. Este gas, transparente, sin olor y compuesto por carbono y oxígeno, se genera de manera natural. Pero la actividad humana ha aumentado considerablemente la cantidad de CO2 que se crea cada día. Su acumulación en la atmósfera evita que el calor del sol vuelva al espacio. Y, así, año tras año, la temperatura del planeta aumenta. En nuestras manos está evitar que esto siga ocurriendo. Una manera de lograrlo es convertir CO2 en etileno y otros productos aprovechables.
Este fenómeno se viene produciendo desde la revolución industrial. Desde entonces, las cantidades de CO2 que se generan son cada vez mayores. Y hace décadas que descubrimos que este exceso de dióxido de carbono es perjudicial. Para el planeta y para prácticamente cualquier forma de vida. Incluyendo la humana. Desde 1990, las emisiones de CO2 han aumentado en más de un 75%. Las causas las encontramos en actividades humanas como la generación de electricidad, que es la principal, pero también en el transporte, la construcción y, en menor medida, en la industria o la agricultura. Actividades en las que la sostenibilidad tiene mucho trabajo por hacer.
Con anterioridad, hemos visto distintos proyectos enfocados a reducir el CO2 que generan esas actividades humanas. De dos maneras: con su almacenamiento o con su reciclaje o transformación en otras materias que puedan emplearse de nuevo. Y sin contaminar. La clave está en dar con un método que resulte económico para poder implementarlo a gran escala. Por ejemplo, el que proponen en el MIT, el prestigioso Massachusetts Institute of Technology. Y que consiste en convertir CO2 en etileno y otros productos que podrían reutilizarse en la industria. Veamos en qué consiste.
Electrodos y reacciones electroquímicas
Desde pequeños, sabemos que en la naturaleza, árboles y plantas absorben dióxido de carbono y producen oxígeno. Este proceso se conoce como fotosíntesis, e implica el uso de luz solar. Pues bien. Este proceso electroquímico, que se da de manera natural a diario, puede reproducirse en laboratorio. Para ello es necesario encontrar los elementos equivalentes a los que componen la fotosíntesis. Y aunque desde hace años se han desarrollado distintas aproximaciones al problema, todavía queda mucho por hacer para dar con el método definitivo.
Investigadores del MIT, el Instituto de Tecnología de Massachusetts, en Estados Unidos, quieren dar con ese método definitivo. Que sea lo más eficiente posible. Para ello han creado un electrodo capaz de descomponer el dióxido de carbono en etileno y otros subproductos. De esta manera, eliminaríamos el CO2 contaminante, y tóxico, y obtendríamos materias primas aprovechables en otras actividades. Sin ir más lejos, el etileno puede usarse como combustible. Pero también para fabricar disolventes, anticongelantes o plásticos.
En concreto, el equipo encabezado por el profesor de ingeniería mecánica Kripa Varanasi, y en el que participan el doctorando Simon Rufer, Michael P. Nitzsche, Sanjay Garimella y Jack R. Lake, han tejido “una serie de cables de cobre conductores a través de una membrana muy delgada para llegar al catalizador”. Ese electrodo está integrado en una solución a base de agua y un material catalizador. A partir de una corriente eléctrica, se da el proceso de convertir CO2 en etileno.
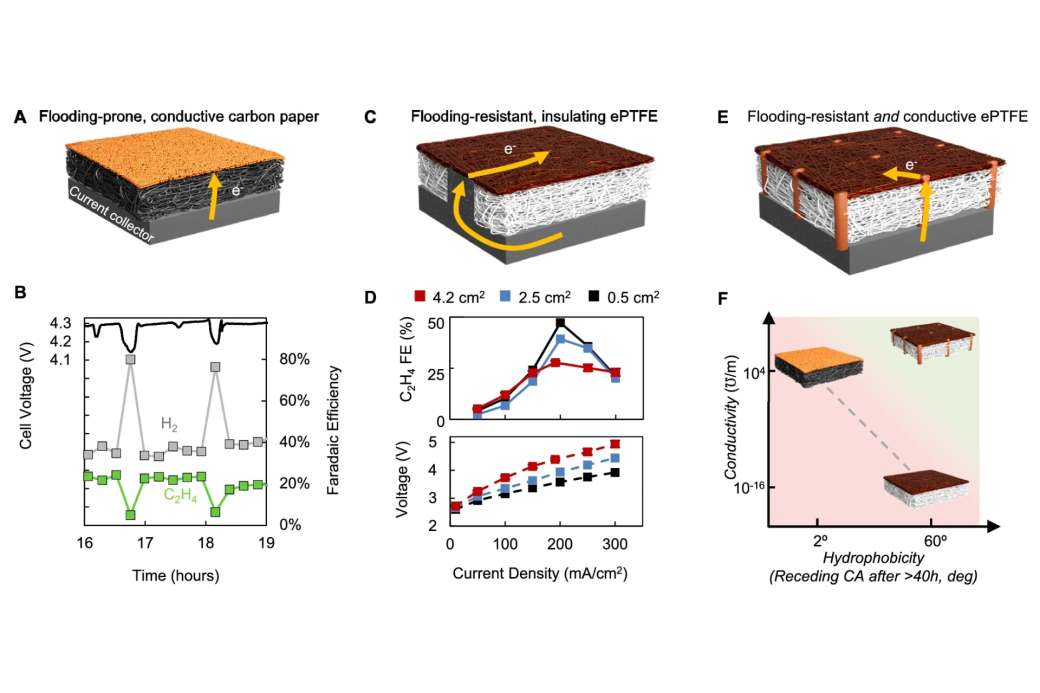
La clave para que la conversión sea lo más eficiente posible está en cumplir dos principios que se contradicen entre sí. Por un lado, los materiales que componen el electrodo “deben ser buenos conductores eléctricos para que la corriente que impulsa el proceso no se desperdicie a través del calentamiento de resistencia. Pero también deben ser hidrófobos o repelentes al agua, para que la solución electrolítica a base de agua no se filtre e interfiera con las reacciones que tienen lugar en la superficie del electrodo”. Desgraciadamente, los materiales disponibles, cuanto más conductores, menos hidrófobos. Y al revés.
Convertir CO2 en etileno de forma simple y eficiente
La solución que encontró el equipo del MIT, encabezado por Kripa Varanasi y Simon Rufer, fue emplear “un material plástico, PTFE (esencialmente teflón), que se sabe que tiene buenas propiedades hidrófobas. Sin embargo, la falta de conductividad del PTFE significa que los electrones deben viajar a través de una capa de catalizador muy delgada, lo que lleva a una caída de voltaje significativa con la distancia. Para superar esta limitación, los investigadores tejieron una serie de cables de cobre conductores a través de una lámina muy delgada de PTFE”.
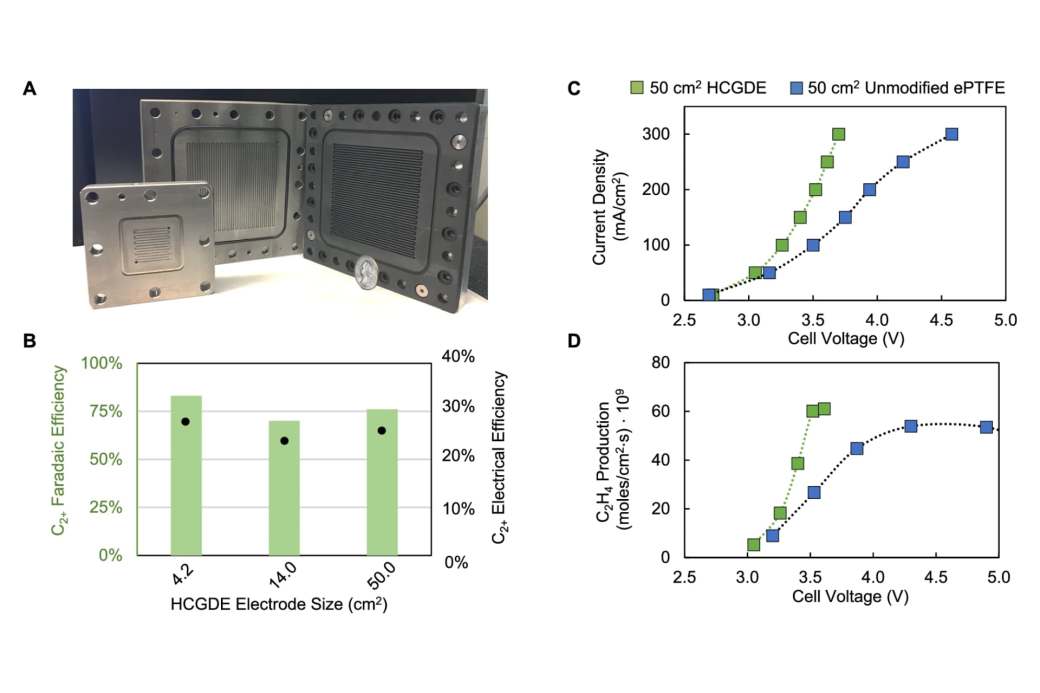
En las pruebas realizadas en el laboratorio, los científicos vieron que a medida que aumentaban el tamaño del electrodo, la conductividad bajaba, por lo que era necesario aplicar más electricidad para realizar el proceso de convertir el CO2 en etileno. Además, con electrodos más grandes, se generaban más residuos. O, mejor dicho, más subproductos no deseados, junto al buscado etileno. Así pues, ¿cómo resolver este problema para aplicar el descubrimiento al mundo real?
Al tejer el alambre a través del material, el material se divide en secciones más pequeñas determinadas por el espaciado de los cables. “Lo dividimos en un montón de pequeños segmentos, cada uno de los cuales es efectivamente un electrodo más pequeño”, dice Simon Rufer. “Y como hemos visto, los electrodos pequeños pueden funcionar muy bien”. Por otro lado, desarrollaron un modelo que captura la variabilidad espacial en el voltaje y la distribución del producto en los electrodos debido a las pérdidas. El modelo, junto con los datos experimentales que recopilaron, les permitió calcular el espacio óptimo para que los cables conductores contrarresten la caída de la conductividad.
El electrodo desarrollado por estos investigadores, así como el sistema catalizador al completo, se puede integrar en cualquier proceso de fabricación y a cualquier escala. Por otro lado, aunque el proyecto tenía como objetivo generar etileno a partir de CO2 de manera eficiente y asequible, el mismo enfoque podría aplicarse a la producción de otros productos químicos de alto valor, como metano, metanol o monóxido de carbono, entre otros.









